人参皂苷的抗肿瘤作用机制以及人参皂苷种类研究
人参被誉为“百草之王”。它的主要活性成分是人参皂苷,它有很多神奇的功效,其中最重要的就是可以抗癌。人参皂苷如何对抗癌症?它有哪些种类和结构?它如何在人体内代谢和改造?它在临床上有哪些应用前景?本文将为您揭开这些问题的答案。
人参皂苷对肿瘤的作用机制【1】
人参皂苷可以通过多种方式来抑制肿瘤细胞的生长和转移。具体来说,它可以:
- 调节细胞周期,使肿瘤细胞停止分裂或延迟进入下一阶段;
- 诱导细胞凋亡,使肿瘤细胞自我毁灭或被免疫系统清除;
- 诱导细胞分化,使肿瘤细胞恢复正常功能或减少恶性程度;
- 靶向肿瘤干细胞,使肿瘤失去自我更新和分化的能力,防止复发和转移。
除了直接作用于肿瘤细胞,人参皂苷还可以改善肿瘤的周围环境,从而间接影响肿瘤的生长和转移。具体来说,它可以:
- 清除活性氧,保护正常细胞免受氧化应激的损伤,防止基因突变和癌变;
- 抑制血管生成,切断肿瘤的供血和供氧,限制肿瘤的大小和扩散;
- 抑制基质金属蛋白酶,降低肿瘤细胞穿透和移动的能力,阻止肿瘤的侵袭和转移。
人参皂苷的种类和结构【1】
人参皂苷有很多种类,主要分为两大类:20(S)-型和20®-型。这两大类又根据其糖基链的不同,分为三醇型和二醇型。不同类型的人参皂苷有不同的抗肿瘤活性和作用机制。例如:
- 人参皂苷Rh1是一种二醇型20(R)-型人参皂苷,它可以通过抑制基质金属蛋白酶9的活性来抑制肺癌细胞的侵袭;
- 人参皂苷Rg3是一种三醇型20(S)-型人参皂苷,它可以通过靶向结肠癌干细胞和血管生成来抑制结肠癌的生长和转移;
- 人参皂苷Rh2是一种二醇型20(R)-型人参皂苷,它可以通过诱导急性髓性白血病细胞的凋亡和分化来抑制急性髓性白血病的发展;
- 人参皂苷aPPD是一种三醇型20(S)-型人参皂苷,它可以通过上调谷氨酸转运蛋白GLT-1的表达来抑制胶质瘤细胞的生长。
人参皂苷的代谢
人参里面含有的人参皂苷,叫做原型人参皂苷。原型人参皂苷分子量太大,并不能直接被吸收利用,需要经消化酶和肠道菌群的代谢作用,降解为小分子的稀有人参皂苷,才能被吸收利用。
但是人的肠道菌群的种类和数量并不相同,只有极少数人的肠道菌群能将原型人参皂苷转化为稀有人参皂苷,大部分人并不具备这个能力。因此,大部分人直接吃人参并不能起到抗癌作用,反而容易引起上火、血压升高等副作用。
所以,需要通过科学加工,将人参中的原型人参皂苷提取出来,在体外经过生物代谢提前转化为活性强、生物利用度高的稀有人参皂苷,才能发挥抗癌作用,并且消除副作用。
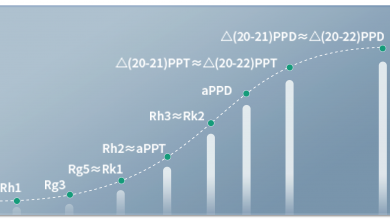
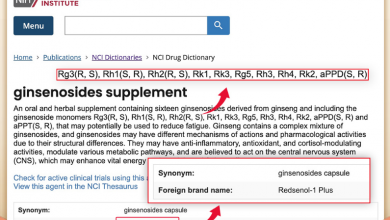
如今在抗癌中广泛使用的人参皂苷都属于稀有人参皂苷,包括人参皂苷Rh2、Rg3、Rk2、Rh3、aPPT、 Rg5、Rk1等。
一项由加拿大皇家以诺植物药公司首席华裔科学家余佩华博士、天津国际生物医药联合研究院的科研团队,以及南开大学药学院杨诚教授共同完成。【2】
研究发现,稀有人参皂苷aPPD具有很强的抗肿瘤活性,对肺癌、肝癌、结直肠癌、乳腺癌、胰腺癌等多种癌细胞具有明显的抑制作用,能抑制癌细胞的生长增值、侵袭和转移。同时,人参皂苷aPPD还能协同增强化疗药、靶向药以及免疫治疗药的抗肿瘤作用。研究发现,稀有人参皂苷aPPD的这些抗癌作用比人参皂苷Rh2、Rg3、Rh3、Rg5更强。
研究结果的另一个重点是发现了人参皂苷aPPD的抗癌机制,aPPD通过Stat3通路发挥抗肿瘤增殖和转移的双重作用,尤其是可以抑制Stat3的磷酸化和二聚化,调节Twist1、E-cadherin等靶基因表达,阻滞肿瘤细胞的上皮-间充质转化,进而抑制肿瘤转移。
这项研究表明,稀有人参皂苷aPPD是一种潜力巨大的抗癌药成分。对抗癌机制的成功探索,有助于加快稀有人参皂苷aPPD被研发成抗癌新药。
参考资料:
【1】Chen T, Li B, Qiu Y, Qiu Z, Qu P. Functional mechanism of Ginsenosides on tumor growth and metastasis. Saudi J Biol Sci. 2018 Jul;25(5):917-922.
【2】Yang, L., Zhang, Xy., Li, K. et al. Protopanaxadiol inhibits epithelial–mesenchymal transition of hepatocellular carcinoma by targeting STAT3 pathway. Cell Death Dis 10, 630 (2019).
除非注明,否则均为瑞得生健康网原创文章,转载必须以链接形式标明本文链接
本文链接:https://redsenol.com/40417.html




_副本-390x220.jpg)






_副本-390x220.jpg)





_副本-390x220.jpg)
发表你的观点