腹部肥胖的张先生最近参与单位组织的体检,体检报告显示他的血脂偏高,超过正常值,血压也偏高,不太理想。医生建议他调整生活方式,注意饮食与休息,尤其要他运动起来,说是适度的运动可以帮助降血脂和血压。
张先生心想,自己运动可能坚持不了太久,血压血脂这一时半会很难通过运动调整好,于是想吃点保健品调理一番。他在网上看到人参皂苷似乎不错,但不知道人参皂苷对降三高到底有没有用?
人参皂苷有何作用?
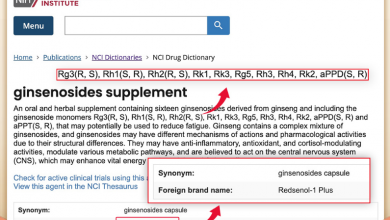
人参皂苷是上世纪60年代科学家在五加科植物(人参、西洋参、三七等)中发现的一种活性成分。大量的研究表明,人参皂苷具有丰富的医学功效,包括抗癌、抗炎、抗氧化、调节免疫力、抗焦虑、改善睡眠、保护心脑血管、营养神经、抗病毒等。
人参皂苷降三高吗?
人参皂苷对心脑血管的保护是如何实现的?能不能降三高呢?
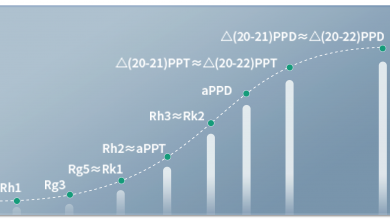
事实上,科学家在研究稀有人参皂苷时发现,稀有人参皂苷能改善血管舒张和收缩功能,改善血管硬化,对高血压和低血压都能起到调节作用。他们还发现稀有人参皂苷在保护血管内皮细胞、舒张血管有确切疗效,可以改善动脉粥样硬化,增加冠状动脉血流,这对于防治冠心病很有帮助。科学家们研究的稀有人参皂苷包括人参皂苷Rh2、Rg3、Rk2、Rh3、aPPD等。
目前,还没有研究发现,人参皂苷对人体血糖是否能有效控制;但科学研究发现,人参皂苷aPPD能显著促进遗传性糖尿病小鼠的伤口愈合,很有希望用于防治糖尿病足溃疡。
最后,要提醒的是,对于肥胖和生活方式带来的三高(高血压、高血脂、高血糖),想要彻底的恢复正常指标,最重要的是改变生活方式,保持健康饮食和作息,肥胖者适当减肥,坚持运动。保健品或药品虽然能帮助降三高,但不能替代健康的生活方式!所以,管住嘴、迈开腿、坚持住才是得到健康体魄的真谛!
除非注明,否则均为瑞得生健康网原创文章,转载必须以链接形式标明本文链接
本文链接:https://redsenol.com/26930.html




_副本-390x220.jpg)









_副本-390x220.jpg)




发表你的观点